1. RWD & RWE
- RWD: Real World Data, 실제임상자료, 다양한 자료원을 통해 수집된 환자의 건강상태/보건의료 전달체계와 관련된 각종 자료
- <내원, 등록, 검사, 처방, 진단> 등의 진료 과정에서 나오는 데이터
- 시판 후 약물의 안전 관리에 많이 활용되고 있음
- Claim Data: 청구 자료, 돈을 받기 위한 data, 보험 심사와 관련됨
- Claim Data의 한계점 → EMR 데이터, 질병 등록 자료 등으로 보완하여 연구 진행
- Disease Registry
- EMR Data
- Social Media Data
- RWE: Real World Evidence, 실제임상근거, RWD의 분석을 통해 얻어진 의약품 등의 사용 및 잠재적인 유익성과 위해성에 관한 임상적인 증거.
- 예를 들어 RWD를 이용해 무작위배정을 하는 실용적인 임상연구(pragmatic clinical trial; PCT 또는 pRCT)를 하거나 무작위배정을 하지 않는 관찰연구(전향적 또는 후향적) 또는 역학연구 등을 수행하여 RWE를 도출할 수 있음
- RWE는 RCT와 같은 임상시험을 통해 생성된 증거를 보충하고 보완하는 데 중요한 역할을 할 수 있음.
- → RCT가 해결하지 못한 증거 격차(evidence gap)를 메울 수 있는 잠재력을 갖고 있다.
- 임상 결과가 실제 환경에 적용될 수 있는지에 대한 일반화 가능성을 확인할 수도 있음
참고) RCT: Randomized Controlled Test(무작위 배정 임상시험)
Controlled Setting: 모두 동일한 조건
Real World: 모두 조금씩 다른 조건
기존의 RCT 연구는 비슷한 환자군(Controlled Setting)을 모집하는 데 많은 시간과 비용을 소비했었음. → 기존 RCT 연구의 한계점
이를 극복하기 위해 RWD를 사용하기로 함. 하지만 Controlled 되지 않은 데이터 Setting으로 인해 기존 RCT 연구에 비교해서 놓칠 수 있는 부분이 존재한다는 한계가 있다.
RWD를 이용해 연구 진행할 때 조심할 부분과 반영 방법 등을 고민해보아야 함.
최근에는 Controlled Setting 보다는 RWD를 기반으로 다양한 연구들이 진행이 되고 있는 추세
- FDA와 Brigham의 RCT DUPLICATE 프로젝트 - 기존의 Controlled Setting으로 진행된 RCT를 RWD로 다시 진행해보는 프로젝트
2. EMR 데이터를 활용한 다기관 약물 감시 연구
약물감시는 의약품의 안전성 프로필을 만들기 위해 여러 데이터 소스를 필요로 하는데, RWD는 이 퍼즐의 일부로서 추가적인 통찰력을 제공한다.
미국 FDA에서는 표준 데이터모델 기반의 능동적 감시체계인 Sentinel initiative을 이용해 미국 전역의 병원 EMR, 보험자료, 환자 등록자료 등을 이용한 빅데이터를 연계하여 실마리 정보 분석, 인과성 평가 및 약물사용 모니터링 등의 안전성 모니터링을 실시하고 있다.
약물 감시: 약 + 감시, 약물이 시판된 이후 약물 의 부갖용과 사용하는 빈도 등에 대해서 감시
- EMR 빅데이터 기반의 능동적 약물 감시(MetaLAB & MetaNurse)
- 의료 빅데이터 기반의 능동적 약물 감시
- 서울대 병원의 입퇴원 기록, 약물처방 기록, LAB 데이터, 간호 데이터 등 이용
- 기존에는 특정 약물/부작용 한 가지에 대해서만 감시하는 연구들이 많이 진행되었는데 그에 반대로 의료 빅데이터 기반으로 전반적이고 능동적인 감시를 목적으로 진행된 첫번째 연구
- 101개 약물로 능동적 약물감시 수행
- EMR 데이터로 찾을 수 있는 전반적인 부작용에 대해 연구 진행
- 757개 MedDRA 부작용 탐색
- ⇒ Data Driven Approach를 사용해서 전반적인 surveilance를 시도한 연구!
- 기존에 알려져 있던 약물들의 부작용을 잘 찾을 수 있었음 + 추가로 새로운 부작용 발견 및 검증 가능 → 다양한 연구로 확장

- FAERS: 미국에서 의사/환자/의료진들이 환자가 특정 약을 처방받고 복용했을 때 나타나는 부작용을 식약처에 보고하여 만드렁진 데이터베이스. RWD의 일종
- 다기관 약물감시 연구 사례(표준데이터모델을 이용한 다기관 의무기록 연계 분석)
- 각 병원마다 EMR 데이터는 구조가 달랐음
- → 공통데이터모델 개념 적용(동일한 데이터 모델로 변환)

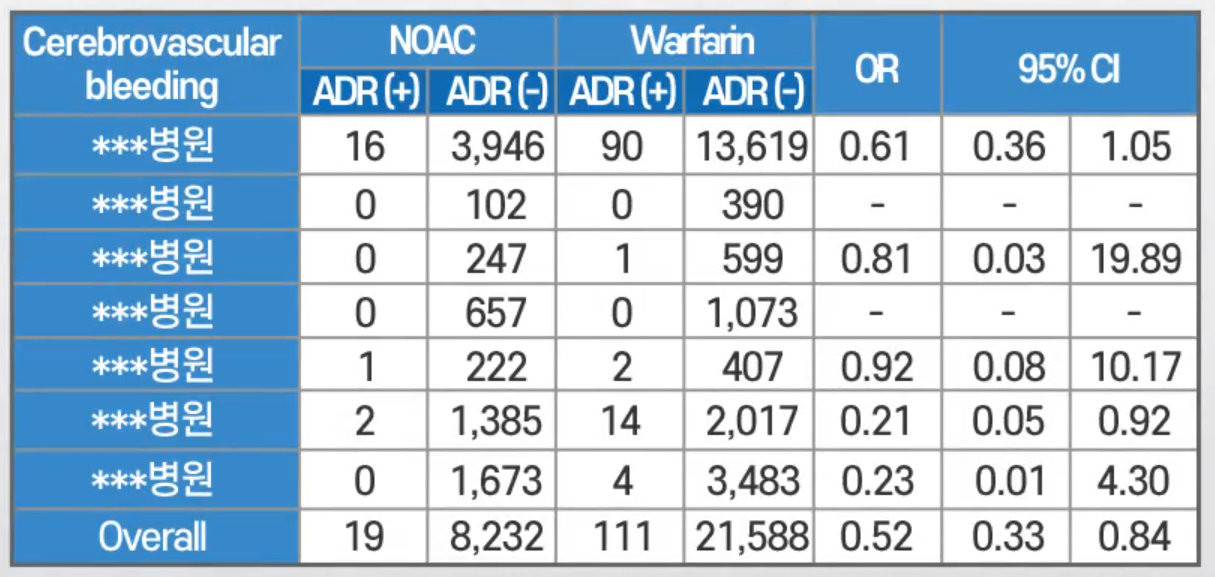
3. RWE 기반 다기관 의약품 부작용 지식 베이스 구축
- RWD 기반 연구가 일회성으로 진행된다는 한계점이 있었음.⇒ RWD, RWE 기반의 일회성으로 다기관 의약품 부작용 지식 베이스 구축
- RWD를 바탕으로 연구/논문을 진행하고 나면 다시 RWE를 생성하는 부분에서 연구자들이 크게 어려움을 겪고 있음.
- Knowledge Base: 수많은 Understanding 데이터 중 유효한 데이터 생산 및 구축과 활용
- 약물 감시 분야 지식 베이스 활용 사례: The FDA Sentinel Initiative - An Evolving National Resource
- Sentinel: 2007년 FDA가 RWD의 중요성을 파악하고 론칭한 약물 안전성 감시 시스템 ⇒ 2016년에 연구 근거가 확산되어 시스템 최종 구현 완료RWD, claim data, EMR 데이터 등을 통해 근거 과학을 발전시키는 플랫폼 역할
- 국내에서도 Sentinel 시스템 적용과 개발을 위해 다양한 시도 중
- 의료 제품 안전성을 사전에 모니터링
- RWD의 발전과 적용을 위해 꼭 필요한 항목: RWD 일회성 분석이 아닌 데이터 수집/활용/근거 마련 등 고민
- RWD 기반 연구에서는 용어의 표준도 중요한 이슈데이터 코드를 보내 분석을 하더라도 의미가 달라질 수 있는 문제가 발생
- 용어의 표준을 정하는 것은 연구 수행의 중요한 부분!
- EMR 구조가 다르듯이 각 병원마다 사용하는 용어도 조금씩 다름
- RWD 기반 약물 감시 모델을 통해 다양한 약물과 증상을 재검증하는 연구 진행
- 약물 부작용 지식베이스 구축 연구 - 식약처 진행(서울대병원, 건양대병원, 한림대병원 참여)모든 약물, 부작용의 결과를 취합하여 지식 베이스 구축을 도모
- 약물 부작용 알고리즘을 공통데이터모델 기반으로 적용
728x90
'Bioinformatics' 카테고리의 다른 글
| 희귀질환 환자 진단 및 치료제 개발을 위한 인공지능의 활용 방안 (0) | 2022.01.31 |
|---|---|
| 정보의학개론 - 임상시험과 자료관리 (0) | 2022.01.04 |
| [논문 리뷰] DeepLung: Deep 3D Dual Path Nets for Automated Pulmonary Nodule Detection and Classification (0) | 2021.11.28 |
| Lung Nodule Classification papers(폐결절 분류 모델) (0) | 2021.11.24 |
| The LIDC/IDRI thoracic CT database of lung nodules: 폐결절 데이터베이스 (0) | 2021.11.24 |
