임상시험의 내용과 목적
임상시험
임상시험: 의약품/의료기기/의료 빅데이터의 안정성과 유효성을 확인하는 것
- 안정성과 유효성은 통계적 검정 방법을 통해 확인
- 통계적 검정은 데이터의 분석을 통해 증명됨
- 임상시험 데이터: 임상시험 계획서에 따라 임상시험 수행 동안 발생되어 수집되는 정보 => 임상시험 결과 판단 근거
- 임상 데이터 관리: 임상 데이터 입력/검증/품질관리
신약: 이미 허가된 의약품과 화학구조 또는 본질 조성이 전혀 새로운 신물질의 약품 또는 유효성분을 포함한 복합제제 의약품
증거 - 안정성, 유효성, 품질, 약동학적 성질
신약의 유효성 및 안전성 확립은 인체에 대한 시험인 임상시험을 통해 실현될 수 있기 때문에, 신약 개발 과정 중에서 임상 시험이 가장 중요한 단계라고 볼 수 있다.
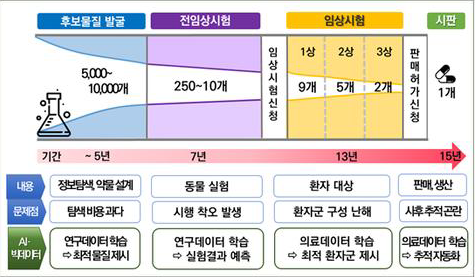
신약 개발의 단계
- 기초탐색 및 원천기술연구
- 개발후보물질 선정
- 전임상(비임상)시험
- 임상시험
- 신약 허가 및 시판
임상 시험의 단계
- Preclinical
- 건강한 소수(안전한가)
- 소수의 환자(안전한 용량은?)
- 다수의 환자(기존 대비 효과?)
- 시판 허가 후 이상반응 관찰

전임상시험(Pre-Clinical)
: 임상시험 진입을 위해 필요
- 제제학적 시험: 안정성/흡수성/용해도 제제의 형태
- 독성시험: 혈중농도와 독성의 관련성
- 약력학적 시험: 주요 약리작용의 profile
- 일반약리 시험: 여러 장기의 기능에 미치는 효과에 대한 profile
- 약동학적 시험: 흡수, 분포, 대사, 배설
- 동물 실험
전임상시험의 한계
- 해부학적 및 생리 기능상의 차이
- 약물의 흡수/분포/대사/배설의 차이
- 병리적인 특성의 차이
- 이상 반응에 대한 커뮤니케이션의 문제
제 1상 임상시험(Phase 1)
- First in human trial
- 소수의 건강한 지원자를 대상(항암제나 HIV 치료제 같은 경우 환자 대상)
- 제 2상 임상시험에 사용할 용량을 찾음
- 1~3개월
제 2상 임상시험(Phase 2)
- 환자에 있어서 시험약의 유효성과 안전성을 평가하여 신약으로서의 가능성과 최적 용량, 용법을 결정하고 치료효과를 탐색하기 위한 시험
- 시험하고자 하는 의약품이 적용될 대상 질환 환자를 대상으로 수행
- 치료약물로서의 가능성을 추정하기 위한 주요 단계
- 치료적 유효성을 탐색
- 약효 입증, 용량-반응양상 검토, 최적의 용량 및 용법 결정
제 3상 임상시험(Phase 3)
- 치료적 확증 임상시험
- 가장 규모가 큰 임상시험, 유효성에 대한 추가 정보 및 확증적 자료를 확보하는 시험
- 다수의 환자에 있어서 시험약의 안전성과 유효성을 대조약과 비교, 검토하여 유효성을 확인
- 통계적 타당성을 확보하기 위한 많은 환자수가 요구되는 단계
- 시판시의 시험약의 label을 확정하기 위한 단계
- 장기 투여, 중증 질환, 병용약제 등 허가 사항에 필요한 대부분의 정보 수집
제 4상 임상시험(Phase 4)
- 치료적 사용 임상시험
- NDA 승인 후에 시행되는 임상연구
- 목적
- 특수 약리작용 검색(약리기전 연구)
- 약물사용이 이환율, 사망률 등에 미치는 효과 검토를 위한 장기간의 대규모 추적연구(PMS, Post-Marketing Surveillance)
- 3상에서 얻은 자료의 보완을 위한 추가 연구: 예상하지 못한 부작용 등
- 시판 전 임상시험에서 검토되지 못한 특수 환자군에 대한 임상시험
- 새로운 적응증 탐색

임상시험 과정 중 자료관리
CDM: Clinical Data Management
- 임상 데이터 관리에는 임상 시험 수행 중에 수집된 데이터의 입력/검증/품질관리 포함
- 규제 기관의 신약 검토/승인은 CDM 핵심 목적인 임상시험 데이터의 무결성에 달려 있음
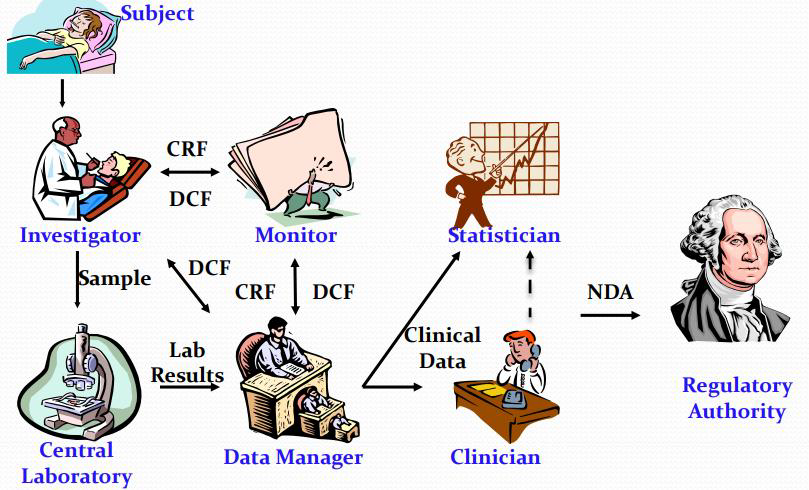
CDM의 목적
- Data Collection, Data Integration, System/Data Validation
CDM의 범위
- 주요 범위: 임상 데이터 수집/검증/분석
- Paper CRF, Electronic CRF, CLinical DB 등 데이터 수집 장비의 설계 및 개발
- Edit Checks, User Acceptance Testing 등과 같은 검증을 위한 도구의 설계 및 개발
- DDR/DDS 등 데이터 분석을 위한 도구 설계 및 개발
CDM의 중요성
- CDM은 시험 대상자로부터 DB 시스템으로 전송되는 데이터의 무결성 및 품질을 보장하는 임상 시험의 핵심 수단임
- 일관되고 정확하며 유효한 임상 데이터 제공
- 최종 결론 및 보고서의 정확성을 지원
- CDM이 보장하는 것
- 수집된 데이터의 완전성/정확성
- DB의 완전성/정확성
- 통계 분석 및 발표/해석을 지원하기에 충분히 명료한 DB

자료 관리의 프로세스
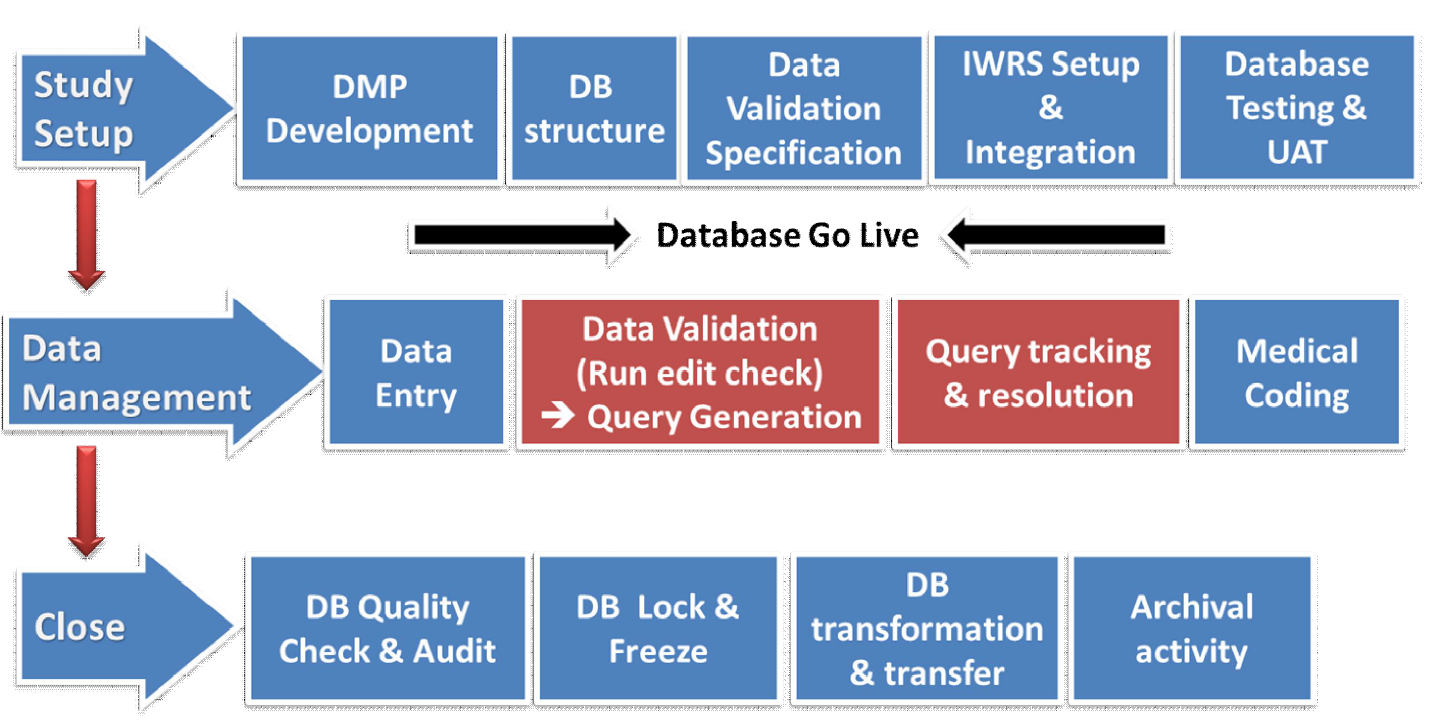
DMP Development
자료관리계획(Data Management Plan)
- 임상자료관리 실무와 규정에 적합하도록 문서화
- 자료관리 각 단계별로 해야할 업무와 필요한 내용을 가이드라인해서 기술
- 목적: 자료관리 업무의 표준화 확립, 의사소통 개선
DB Structure
- CRF 기반으로 자료 입력을 위한 준비과정으로서 DB 테이블 구조 만들고 변수 생성하는 과정
- Annotated CRF 및 Data Dictionary 개발
- 목적: 수집된 자료의 특징 및 속성에 맞게 DB 구조를 설계하여 자료 관리를 효율적으로 하기 위함




Data Validation Specification
- 자료 검증 방안(DVS)
- 자료 입력 후 CRF(Case Report Form) 상의 오류를 검출하기 위한 질의 항목을 생성하기 위하여 사전 정의 및 목록화 하는 과정
- 목적: 분석과 보고를 위해 자료의 무결성 최대화
IWRS Setup & Integration
- 자료입력화면 개발
- IWRS(Interactive Web Response Systems), DVS 내용 등을 포함하여 EDC 시스템을 통해 수집된 CRF 자료를 전자 자료로 가져가기 위한 입력 화면을 만드는 과정
- 목적: 수집된 CRF의 자료를 최종 저장하여 DB화하고 전자자료로 정확/신속하게 입력, 검증 가능하도록 입력화면을 개발하기 위함
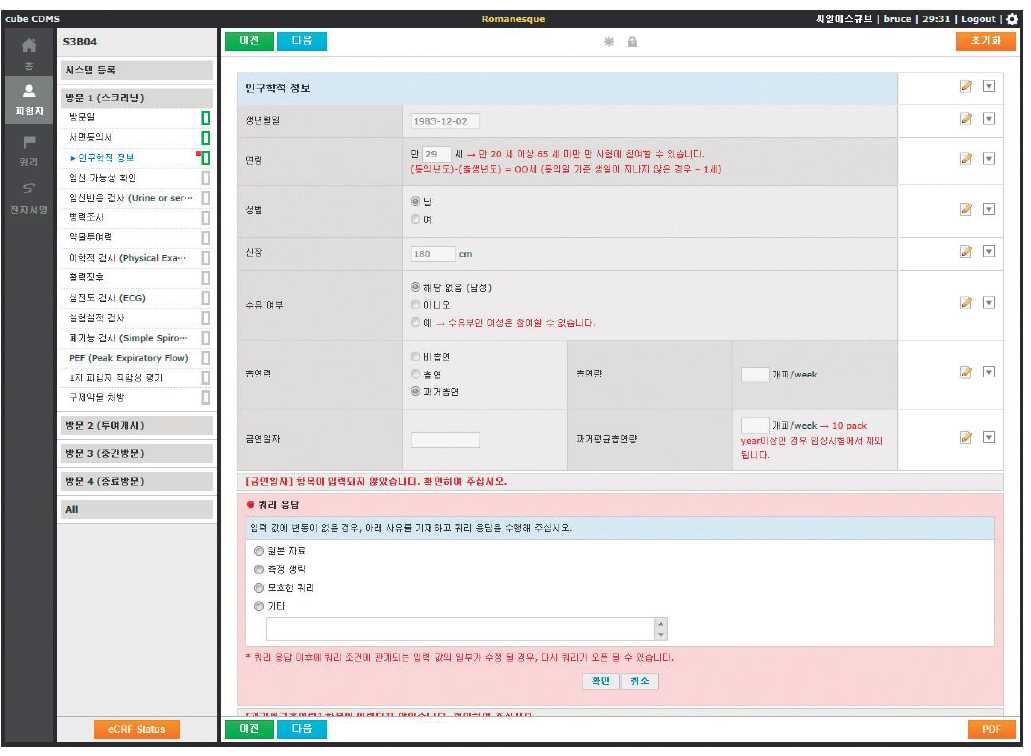
- EDC: 임상 시험 자료를 효과적 처리 하기 위해 컴퓨터 기술 접목된 시스템
- 시험 대상자/참여 기관이 많거나 기간이 길고 복잡한 연구에 적합함
- e-CRF: 종이 CRF를 단순히 전산화한 것, EDC는 조금 더 다양한 기능과 넓은 의미
- CDMS: EDC + Data 관리 기능 추가
Data Entry
CRF 또는 Source Documents로 수집된 자료들을 전자 자료로 변환하여 데이터베이스에 저장하기 위해 자료입력화면을 이용하여 입력하는 과정 => 자료 입력 정확성/통일성을 위해 가이드라인 필요
Data Validation
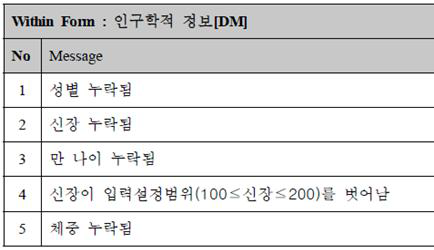
입력된 자료 중 누락된 값, 부적절한 값이 들어간 항목, 전후 내용이 논리적으로 맞지 않는 것 등 확인이 필요한 질의를 생성하여 연구자에게 보내 회수된 질의 답변을 데이터베이스에 정정하는 과정
Medical Coding
이상반응(AE, 유해사례)과 병용약물(Medication) 등에 대하여 표준용어체계(Dictionary)를 이용하여 표준화된 용어로 분류하는 작업 과정
DB Quality Check
자료 검증 완료된 자료들을 대상으로 근거 문서(CRF, DCF 등)와 비교하여 오류가 있는지 확인하는 과정
임상시험 자료의 설득력을 나타내는 지표
DB Lock & Freeze
검증 및 확인 과정이 완료된 DB를 수정할 수 없도록 접근 권한에 대한 제한을 하는 일련의 절차(무결성 확보)
DB tranformation & Transfer
통계분석에 적합한 형태와 구조로 변경
Archival activity
자료 관리 과정 시 생성한 모든 문서가 보관된 자료 관리 마스터 파일 정리, DB 백업 및 보관
* 임상시험 자료의 의무 보관기간은 허가일로부터 3년
'Bioinformatics' 카테고리의 다른 글
| R과 SEER DB를 활용한 데이터 분석 (1) | 2022.02.08 |
|---|---|
| 희귀질환 환자 진단 및 치료제 개발을 위한 인공지능의 활용 방안 (0) | 2022.01.31 |
| 정보의학개론 - 연구정보시스템과 Clinical Research Informatics (0) | 2022.01.03 |
| [논문 리뷰] DeepLung: Deep 3D Dual Path Nets for Automated Pulmonary Nodule Detection and Classification (0) | 2021.11.28 |
| Lung Nodule Classification papers(폐결절 분류 모델) (0) | 2021.11.24 |
